Chemikalien helfen Landwirten und Besitzern kleiner Parzellen, Pflanzen vor Krankheiten zu schützen und die Bodenfruchtbarkeit zu erhöhen. Im Frühjahr benötigen Pflanzen vor allem einen Makronährstoff wie Stickstoff, der in vielen Industriedüngern enthalten ist. Ammoniumnitrat hat einen anderen Namen – Ammoniumnitrat. Das Produkt hilft, die Produktivität auch unter ungünstigen klimatischen Bedingungen zu steigern.
- Ist es Ammoniumnitrat?
- Physikalische Eigenschaften
- Löslichkeit
- Verbindung
- Empfangsmethoden
- Chemische Eigenschaften
- Gebrauchsanweisung als Dünger
- Wann auf den Boden auftragen?
- Aufwandmengen für verschiedene Pflanzen
- Düngung von Winterkulturen
- Anwendung gegen Unkraut
- Sicherheitsmaßnahmen
- Vorteile und Nachteile
- Aufbewahrungsregeln
Ist es Ammoniumnitrat?
Ammoniumnitrat ist ein reiner Stickstoffdünger, dessen Gehalt an der Hauptsubstanz zwischen 26 und 34 % liegt. Nach diesem Indikator steht Ammoniumnitrat nach Harnstoff an zweiter Stelle. Hersteller produzieren zwei Arten von Chemikalien: Ammoniumnitrat mit der Kennzeichnung „A“ ist für den industriellen Einsatz bestimmt, und das mit „B“ gekennzeichnete Ammoniumnitrat ist für den Einsatz in der Landwirtschaft bestimmt.
Ammoniumnitrat hat einen anderen Namen – Ammoniumnitrat – und wurde erstmals 1659 vom Chemiker Johann Glauber gewonnen. Ammoniumnitrat wird als Bestandteil von Sprengstoffen und als Stickstoffdünger in der Landwirtschaft verwendet. Seine chemische Formel ist NH4NEIN3.
Einheimische Landwirte und Gärtner verwenden Stickstoffdünger, um die Pflanzenproduktivität zu steigern und die Widerstandsfähigkeit der Pflanzen gegenüber widrigen Wetterbedingungen zu erhöhen. Es wird sowohl als Einzelwirkstoff als auch in Kombination mit anderen Chemikalien eingesetzt. Im Herbst und Frühling kommt Trockendünger zum Einsatz, für die Wurzeldüngung im Frühsommer eignen sich flüssige Lösungen.
Physikalische Eigenschaften
Als Ergebnis der Forschung zu dem Stoff beschrieben Wissenschaftler seine physikalischen Eigenschaften, die bei der Düngung auf ihren Parzellen berücksichtigt werden müssen. Die Chemikalie wird in Form eines weißen oder gelblichen kristallinen Pulvers vermarktet.
Löslichkeit
Die Löslichkeit von Ammoniumnitrat in Wasser hängt von der Temperatur der Flüssigkeit ab; Bei 0 Grad beträgt dieser Wert also 119 g/100 ml und bei 100 Grad 1024 g/100 ml. Ammoniumnitrat ist auch in Methanol, Ethanol und Pyridin löslich. Bei der Zersetzung eines Stoffes kommt es zu einer starken Wärmeaufnahme, die den Auflösungsprozess stark verlangsamt.
Verbindung
Die Zusammensetzung einer Chemikalie hängt direkt von ihrer Herkunft ab. Im ersten Fall wird Ammoniumnitrat durch Neutralisation eines Salpetersäuresalzes gewonnen. Im zweiten Fall entsteht der Stoff durch chemische Reaktionen von Ausgangsstoffen.
Der wichtigste nützliche Bestandteil des Düngemittels ist Stickstoff, er enthält etwa 35 %. Darüber hinaus enthält Ammoniumnitrat 60 % Sauerstoff und 5 % Wasserstoff. Obwohl Pflanzen Stickstoff benötigen, um grüne Masse zu bilden und Früchte zu tragen, verschlechtert eine übermäßige Düngung die Frostbeständigkeit mehrjähriger Kulturen und verlangsamt das Herbstwachstum von Bäumen und Sträuchern.
Der hohe Stickstoffgehalt im Dünger trägt dazu bei, den Prozess der Photosynthese zu verbessern, die Produktivität zu steigern und die Haltbarkeit von Früchten zu verlängern.
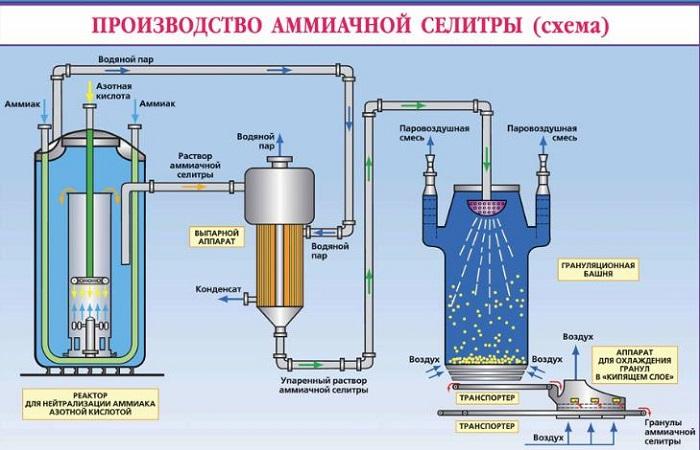
Empfangsmethoden
Das Prinzip der Ammoniumnitratherstellung basiert auf der Neutralisation von Salpetersäure mit Ammoniakgas. Danach wird die resultierende Lösung eingedampft, um Kristalle oder Pulver zu bilden. Um die Haltbarkeit des Düngers zu verlängern, wird er mit speziellen Verbindungen beschichtet, die ein Anbacken verhindern.
Die Technologie zur Herstellung von Ammoniumnitrat besteht aus den folgenden Schritten:
- Der Prozess der Neutralisierung von Salpetersäure mit Ammoniak.
- Verdampfen Sie die resultierende Lösung.
- Salzkristallisationsprozess.
- Trocknen und Abkühlen einer Substanz.
Da der Prozess mit einer starken Wärmeentwicklung einhergeht, ist die Durchführung des Verfahrens außerhalb der Fabrikumgebung sehr gefährlich.
Chemische Eigenschaften
Bei hohen Temperaturen zersetzt sich Ammoniumnitrat. Dieser Prozess löst die Freisetzung einer großen Menge Wärme und Oxidationsmittel aus. Ammoniumnitrat reagiert auch mit alkalischen Substanzen, wobei Ammoniak freigesetzt wird. Bei chemischen Prozessen ist Vorsicht geboten, da der Stoff explosiv ist.
Gebrauchsanweisung als Dünger
Aufgrund des hohen Stickstoffgehalts im Dünger empfiehlt sich der Einsatz in folgenden Fällen:
- zur Fütterung von Zierpflanzen und Blumen (fördert intensives Wachstum der Grünmasse);
- zur Sättigung von Böden jeglicher Art mit Stickstoff;
- zur Fütterung von Kulturpflanzen in jeder Phase der Vegetationsperiode.
Da Salpeter explosiv ist, müssen alle Arbeiten mit Düngemitteln mit äußerster Vorsicht durchgeführt werden und die Empfehlungen des Herstellers befolgt werden.
Wann auf den Boden auftragen?
Ammoniumnitrat wird sowohl im Frühjahr als auch im Herbst ausgebracht. Wenn der Boden auf dem Gelände leicht ist, wird empfohlen, dies vor der Aussaat von Kulturpflanzen zu tun. Bei schweren und lehmigen Böden muss sowohl im Frühjahr als auch im Herbst gedüngt werden. Der Großteil des Ammoniumnitrats wird dem Boden in den Frühlingsmonaten und im Frühsommer zugesetzt, um die Entwicklung und das Wachstum der grünen Pflanzenmasse zu stimulieren.
Was die Dosierung angeht, beträgt der Verbrauch auf armen Böden 35 Gramm Dünger pro Quadratmeter. Wenn der Boden ständig mit organischen Stoffen und Mineraldüngern versorgt wird, reichen 25 Gramm für die gleiche Fläche.
Aufwandmengen für verschiedene Pflanzen
Die zulässige Düngermenge hängt von der Art der Kultur ab, die auf dem Gelände angebaut wird.Mineraldünger darf nicht nur für ausgewachsene Pflanzen, sondern auch für Setzlinge verwendet werden, um diese zu stärken und ihre Stabilität nach der Aussaat im Freiland zu erhöhen. Gießen Sie unter jeden Busch einen Esslöffel Ammoniumnitrat.
Die Verbrauchsraten für erwachsene Pflanzen sind wie folgt:
- Gemüsepflanzen. Der Dünger wird während der Vegetationsperiode der Pflanzen zweimal verwendet – vor dem Austrieb der Knospen und zum Zeitpunkt des Fruchtansatzes. Nehmen Sie jedes Mal 5 bis 10 Gramm pro Quadratmeter Garten.
- Obst- und Beerenbäume. Die erste Düngung erfolgt in trockener Form im Frühjahr, wenn die Blätter auf den Pflanzen erscheinen, wobei eine Dosierung von 15 bis 20 Gramm Dünger pro Quadratmeter Gartenfläche eingehalten wird. Beim zweiten und dritten Mal wird eine flüssige Form der Chemikalie zur Ernährung der Pflanzen verwendet. 30 Gramm Pulver oder Granulat werden in 10 Liter sauberem Wasser verdünnt und diese Lösung wird zum Bewässern der Wurzeln verwendet.
- Wurzelgemüse. Um Dünger zwischen den Pflanzreihen auszubringen, ziehen Sie flache Furchen und streuen Sie Ammoniumnitrat in einer Menge von 7 Gramm Dünger pro Quadratmeter hinein. Der Dünger wird einmal pro Saison, drei Wochen nach der Keimung der Pflanze, ausgebracht.
- Blumenkulturen. Die Pflanzen werden mit einem flüssigen Dünger gefüttert. 10 Körnchen Ammoniumnitrat werden in 1 Liter Wasser gelöst und die Wurzelfütterung durchgeführt.
Düngung von Winterkulturen
Vor dem Winter gepflanzte Pflanzen werden im Herbst mit Ammoniumnitrat gedüngt. Pro Hektar Feld werden 300 kg Dünger in Pulver- oder Granulatform verbraucht.
Anwendung gegen Unkraut
Um Unkraut auf dem Feld zu vernichten, müssen Sie eine konzentrierte Lösung herstellen. Lösen Sie dazu 3 kg Ammoniumnitrat in einem Eimer Wasser auf. Mit dieser Flüssigkeit werden Unkräuter besprüht.Die Lösung vernichtet alle Arten von Unkräutern, schadet aber weder dem Boden noch der menschlichen Gesundheit, da das Ammoniak nach einiger Zeit verdunstet.
Sicherheitsmaßnahmen
Befolgen Sie beim Umgang mit Chemikalien die Sicherheitsregeln, um Ihre Gesundheit nicht zu gefährden. Tragen Sie unbedingt Kleidung, die alle Körperteile bedeckt, Handschuhe und eine Atemschutzmaske, damit Ammoniumnitratdämpfe nicht in die Atemwege gelangen.
Vorteile und Nachteile
Wie jeder Dünger hat auch Ammoniumnitrat seine Vor- und Nachteile, die vor der Verwendung untersucht werden müssen.
Zu den Vorteilen der Chemikalie gehören:
- niedrige Kosten im Vergleich zu anderen Mineralstoffzusätzen;
- keine tiefe Einbettung erforderlich;
- doppelte Wirkung – sowohl kurzfristig als auch länger;
Zu den Nachteilen des Arzneimittels gehören:
- Gefahr einer Selbstentzündung und Explosion bei unsachgemäßer Verwendung;
- Leistungsverlust bei Lagerung in einem feuchten Raum.
Aufbewahrungsregeln
Bewahren Sie die Chemikalie in einem trockenen und dunklen Hauswirtschaftsraum auf.